Kutatócsoportok
HCEMM-USZ Agyi Keringés és Metabolizmus Kutatócsoport
A folyamatos, háborítatlan vérellátás az agy optimális működéséhez elengedhetetlen. Az agy a teljes testtömeg 2%-át adja, míg a szív által kipumpált vér 15%-a az agyba jut, az agy részesedése a nyugalmi oxigénfelhasználásból 20%. Ezek az adatok is jól szemléltetik, hogy az agyi vérellátás csökkenése, vagy bármilyen rövid időre történő megszűnése komoly következményekkel jár az idegszövet működésére. Kísérletes munkánk célja annak megértése, hogy az agyérbetegségek milyen mechanizmusok útján károsítják az agyszövetet.
Kutatásaink fókuszában a stroke betegség áll. A stroke-ot követő állapotromlás sikeres vissza-szorításának alapja azoknak a kórfolyamatoknak a felismerése, amelyek a másodlagos sérülések létrejöttében és kifejeződésében (pl. agyödéma, vazospazmus, hypoperfúzió) központi szereppel bírnak. Ilyen kórfolyamatként ismert az agykérgi terjedő depolarizáció. Célkitűzésünk, hogy megismerjük a terjedő depolarizáció által aktivált jelátviteli útvonalakat, és hogy jellemezzük az agyi iszkémiában megjelenő kúszó depolarizációk tulajdonságait az idős kor függvényében. A téma korszerű és időszerű, hiszen az agyérbetegségek zömében az idősödő korosztályt érintik. Kutatásaink klinikailag is hasznosulhatnak, hiszen a terjedő depolarizáció kialakulásának megakadályozása eredményt hozhat az iszkémiás agysérülésen átesett betegek sikeresebb felépülésében.
A csoport tagjai
- Prof. Dr. Farkas Eszter
- Dr. Menyhárt Ákos
- Dr. V. Kecskés Szilvia
- Dr. Frank Rita
- Dr. Törteli Anna
- Dr. Pesti István
- Somogyi Petra
Bél-agy tengely kutatócsoport

A gyomor-bél traktusban meghúzódó enterális idegrendszert nem hiába nevezik angolul „kicsi agynak”: a központi idegrendszerrel való kapcsolat nélkül is komplex funkciók ellátására képes, és idegsejtjeinek száma emberben a gerincvelőhöz mérhetően százmilliós nagyságrendű. Bár gyakran „második agyként” említik, evolúciósan inkább az „első agy”, hiszen már agy nélküli élőlényekben, például hidrákban is megtalálható. A gyomor-bél-traktus karmestereként felelős a bélnyálkahártya szekréciója, áteresztőképessége, vérátáramlása, a bélmozgások szabályozásában, és az aggyal is folyamatosan kommunikál. Immunsejtjeink 70-80%-a a gyomor-bélrendszerben található, így működése szoros kapcsolatban áll az immunrendszerrel, valamint a bélrendszerben élő mikrobákkal. Az utóbbi években számos központi idegrendszeri betegségben, így a stroke és az Alzheimer-kór esetében is felmerült a bél-agy tengely szerepe. Kutatásaink fókuszában az enterális idegrendszer élettani és kóros működése és a bél-agy-kölcsönhatás zavarai által okozott betegségek állnak. Kísérleteinkben olyan népbetegségek, mint a funkcionális diszpepszia, az irritábilis bél szindróma és az akut iszkémiás stroke esetében vizsgáljuk az enterális idegrendszer és kölcsönhatásai szerepét. Célunk, hogy kutatási eredményeink a betegek számára közvetlenül is hasznosulhassanak potenciális új gyógymódok és diagnosztikus lehetőségek formájában.
A csoport tagjai
Neuroinflammációs Kutatócsoport
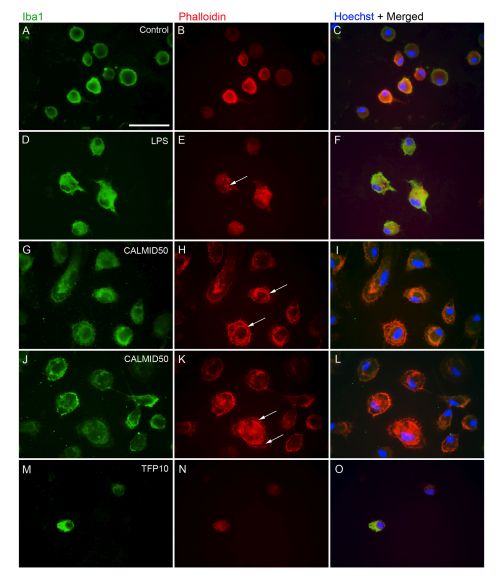 Az embrionális és újszülött előagyi tenyészetekben nyugalmi és aktivált mikrogliasejtek különböző paraméterekkel jellemezhető populációi vannak jelen, amelyek kvantitatív morfológiai, molekuláris/immuncitokémiai és funkcionális (proliferáció, fagocitózis) módszerekkel elkülöníthetők. Vizsgálatainkban gyulladást kiváltó és ezeket a folyamatokat gátló szerek hatását tanulmányozzuk mikroglia-tenyészetekben úgy, hogy kvantitatív morfológiai, funkcionális (sejtproliferáció és életképesség, fagocitózis, motilitás) és génexpressziós vizsgálati módszerekkel jellemezzük a mozgáshoz és a fagocitózishoz nélkülözhetetlen aktin citoszkeleton reorganizációját. A pro- és anti-inflammatorikus gének epigenetikus és transzkripcionális szabályozásának vizsgálata mellett elemezzük azokat az intracelluláris jelutakat is, amelyek a mikrogliasejtek aktivációjában fontosak lehetnek.
Az embrionális és újszülött előagyi tenyészetekben nyugalmi és aktivált mikrogliasejtek különböző paraméterekkel jellemezhető populációi vannak jelen, amelyek kvantitatív morfológiai, molekuláris/immuncitokémiai és funkcionális (proliferáció, fagocitózis) módszerekkel elkülöníthetők. Vizsgálatainkban gyulladást kiváltó és ezeket a folyamatokat gátló szerek hatását tanulmányozzuk mikroglia-tenyészetekben úgy, hogy kvantitatív morfológiai, funkcionális (sejtproliferáció és életképesség, fagocitózis, motilitás) és génexpressziós vizsgálati módszerekkel jellemezzük a mozgáshoz és a fagocitózishoz nélkülözhetetlen aktin citoszkeleton reorganizációját. A pro- és anti-inflammatorikus gének epigenetikus és transzkripcionális szabályozásának vizsgálata mellett elemezzük azokat az intracelluláris jelutakat is, amelyek a mikrogliasejtek aktivációjában fontosak lehetnek.
Kísérleteinkben a tenyésztés körülményeinek különböző faktorait (hőmérséklet, gyulladási faktorok, ozmotikus sokk stb.) kombináljuk az aktin sejtkortex alkotóelemeinek inhibitoraival, gyulladási folyamatokat befolyásoló szerekkel és egyéb farmakonokkal. Vizsgálataink alkalmasak lehetnek a neuroinflammáció, a neurodegeneráció és -regeneráció bizonyos folyamatainak modellezésére (pl. Alzheimer-kór, Huntington-kór), s hozzájárulhatnak a mikrogliasejtek pro-inflammatorikus és anti-inflammatorikus válaszainak jobb megértéséhez.
Ezek a vizsgálatok egy olyan multidiszciplináris kutatási panelhez illeszkednek, ahol a hatásos terápia megtervezése érdekében különböző in vivo és in vitro rendszerekben vizsgáljuk a fiziológiástól eltérő idegszövet molekuláris és celluláris mechanizmusait.
A csoport tagjai


